1Juana Suárez-García, 2Mario Valle-Sánchez, 3Erick Cuevas-Yañez
Los colorantes son especies químicas que dan color a las cosas, pero… ¿Cómo lo hacen? ¿Sirven para algo más? ¿Qué pasa si los modifico? Todo esto abre un mundo de posibilidades una vez que nos ponemos a pensar en estas preguntas, desde “generar nuevos colores” hasta “acelerar procesos químicos” ayudados por la energía de la luz.
Introducción
Los colores son una parte esencial en nuestras vidas, desde que abrimos los ojos, interactuamos con ellos, influyen en nuestro humor, apetito o gustos. Pueden ser naturales o sintéticos, los encontramos en el cielo, las flores, cosméticos, telas, adornos, pinturas… En fin. Todos ellos provienen de pigmentos, colorantes y otros compuestos que reaccionan o interactúan con la luz, llevándola a absorber o emitir los colores que logramos observar.
Los colorantes
La humanidad ha usado pigmentos y colorantes desde el comienzo de la historia, lo podemos ver en pinturas rupestres y demás vestigios, mientras que en términos sintéticos son entidades relativamente nuevas (se lograron obtener a finales del siglo XIX) dando paso al desarrollo de la gran industria química.(Christie, 2014) Dentro de estos últimos, hay uno que destaca por su versatilidad, hablamos del colorante azul de metileno.
Azul de metileno, el colorante MULTIUSOS
El azul de metileno es reconocido por su uso como colorante de telas y papel. También es requerido en la industria de alimentos, cosméticos y farmacéutica. Fue sintetizado por primera vez por Heinrich Caro en 1876 y empleado como un tinte a base de anilina para teñir algodón.(Khodaie et al., 2013) Ehrlich estudió la intensidad de la tinción de varios órganos inyectando MB en tejido animal vivo; y también fue utilizado contra la enfermedad del paludismo y malaria a finales del siglo XIX, actualmente se emplea como auxiliar en situaciones donde el paciente presenta trastornos en los glóbulos rojos, hipotensión, y la dificultad celular para captar oxígeno. El azul de metileno, un colorante muy explotable, que ha desempeñado un papel muy importante por muchos años; ya que se ha empleado para teñir desde papel y telas hasta bacterias y tejidos; permite diagnosticar ciertas infecciones; sirve como agente desinfectante para cuidar peces, desinfectar huevos, tratar heridas leves e incluso como antídoto contra intoxicaciones por amoniaco o nitritos (embutidos mal encurtidos).(Khan et al., 2022)
¿Para hacer reacciones químicas?
Dentro de todos los usos que se han comentado existe una relación, captar oxígeno y electrones. La naturaleza química del azul de metileno es muy interesante ya que facilita la generación de radicales libres, característica de las reacciones fotoquímicas o que necesitan de la luz para que sucedan. Por decirlo de una manera sencilla, el azul de metileno sirve como una antena que capta la energía de la luz y a su vez interactúa con las moléculas de oxígeno, rompiéndola para generar radicales de oxígeno, que son los que permiten que las reacciones puedan realizarse, a esto se le conoce como fotosensibilizador.(Zhang et al., 2018) (Figura 1)
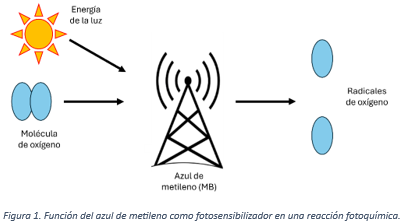
El estudio de las reacciones fotoquímicas ha permitido desarrollar avances muy grandes en la medicina en las terapias contra el cáncer, que tantas pérdidas ha causado a la humanidad, y ha permitido que se use su ejemplo con otros colorantes para desarrollar más herramientas de uso cotidiano en las diferentes disciplinas que tienen como base a la química, sin embargo, aún existe mucho camino por recorrer y reacciones por descubrir.
Palabras clave: Azul de metileno, fotosensibilizador, reacciones fotoquímicas.
Autores:
1Juana Suárez-García: Laboratorio de Química Orgánica, Centro Conjunto de Investigación en Química Sustentable. [email protected], https://orcid.org/0009-0008-8504-8455.
2Mario Valle-Sánchez: Laboratorio de Química Orgánica, Centro Conjunto de Investigación en Química Sustentable. [email protected], https://orcid.org/0000-0001-7415-203X.
3Erick Cuevas-Yañez: Laboratorio de Química Orgánica, Centro Conjunto de Investigación en Química Sustentable. [email protected], https://orcid.org/0000-0002-9437-637X.
Referencias
Christie, R. (2014). Colour Chemistry. The Royal Society of Chemistry. https://doi.org/10.1039/9781782626510
Khan, I., Saeed, K., Zekker, I., Zhang, B., Hendi, A. H., Ahmad, A., Ahmad, S., Zada, N., Ahmad, H., Shah, L. A., Shah, T., & Khan, I. (2022). Review on Methylene Blue: Its Properties, Uses, Toxicity and Photodegradation. In Water (Vol. 14, Issue 2). https://doi.org/10.3390/w14020242
Khodaie, M., Ghasemi, N., Moradi, B., & Rahimi, M. (2013). Removal of Methylene Blue from Wastewater by Adsorption onto ZnCl2 Activated Corn Husk Carbon Equilibrium Studies. Journal of Chemistry, 2013(1), 383985. https://doi.org/https://doi.org/10.1155/2013/383985
Zhang, J., Jiang, C., Figueiró Longo, J. P., Azevedo, R. B., Zhang, H., & Muehlmann, L. A. (2018). An updated overview on the development of new photosensitizers for anticancer photodynamic therapy. Acta Pharmaceutica Sinica B, 8(2), 137–146. https://doi.org/https://doi.org/10.1016/j.apsb.2017.09.003
