Mata-López Diana Laura1, Gómez-García J Francisco2
“La química del estado sólido es el arte de construir arreglos atómicos deseables basándose en la información oculta en la tabla periódica.” (Abakumov A.M, Fedotov S.S., Antipov E.V. y Tarascon J.M., 2020)
La cantidad de energía que necesita nuestra sociedad crece día con día y con ello, también, la necesidad de desarrollar dispositivos que puedan almacenar y distribuir energía eléctrica de manera eficiente. Nuestra vida cotidiana se basa en el uso de dispositivos electrónicos o tecnologías que dependen de estos, como el internet, porque ya no imaginamos nuestra vida sin celulares, computadoras, pantallas ni redes sociales. Por esta razón se necesitan baterías más eficientes y con mayor capacidad de almacenamiento para dispositivos más pequeños, como ejemplo están las baterías de ion-litio.
A nivel industrial estas baterías no funcionan de la mejor manera, se necesitan de dispositivos más grandes, menos costosos, pero igual de eficientes que las baterías de ion-litio que encontramos en nuestros dispositivos. Una batería, a grandes rasgos, está compuesta por una terminal positiva conocida como cátodo y una negativa llamada ánodo. Cuando una batería se carga, los electrones viajan del ánodo al cátodo, pero necesitan por dónde moverse, a este “medio” para moverse se le conoce como electrolito, este contiene muchos iones y una membrana, que se encarga de que solamente se muevan los iones de un lado a otro (figura 1).
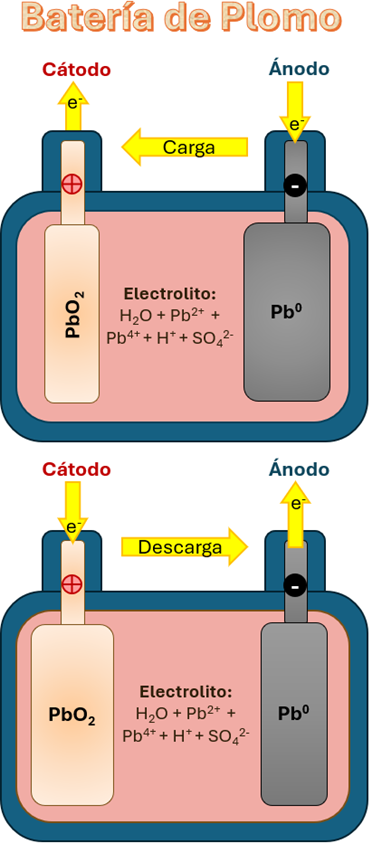
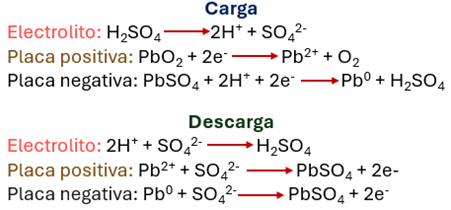
Un problema de las baterías es el uso de disolventes orgánicos volátiles, medios ácidos o básicos que presentan riesgos a la salud y para el medio ambiente, por eso un reto actual es buscar disolventes que los sustituyan y no tengan los problemas de volatilidad, toxicidad o explosión. Otro problema que tienen las baterías ácidas (como las baterías de auto) es que se emplean electrolitos ácidos, que son peligrosos a temperaturas mayores a 200 °C (aumentando el riesgo de explosión), y particularmente las baterías de ion-litio tienen el problema de la escasez y el alto costo del litio. Es aquí donde las baterías de óxidos sólidos (SSB, por sus siglas en inglés) juegan un papel importante. Las baterías en estado sólido se componen de manera similar a las baterías convencionales, la única diferencia se encuentra en que estas utilizan materiales sólidos que funcionan como electrolito y membrana y que trabajan mejor a temperaturas altas (mayores a 400 °C) en dispositivos más grandes (figura 2).
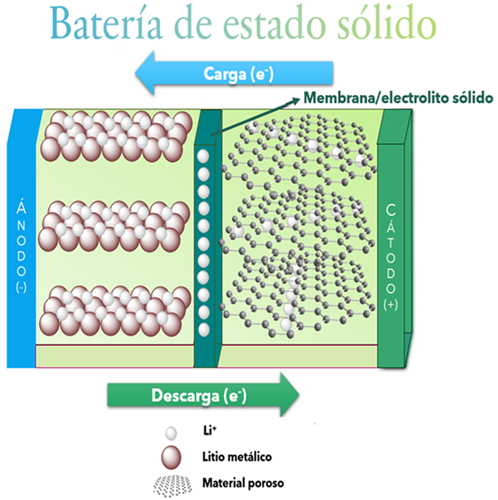
Los iones en los óxidos de estas baterías están ordenados de manera repetitiva, sin embargo, pueden presentar defectos, como irregularidades dentro de su orden, la pérdida de un átomo formando “huecos” o que se encuentre en una posición que no le corresponde, lo cual puede beneficiar o empeorar la manera en que los electrones se mueven en el material.
Las principales ventajas de las baterías de estado sólido son que estas no requieren del uso de un electrolito líquido, es decir, un disolvente orgánico volátil o ácido, por lo que se pueden usar a temperaturas más altas que las baterías convencionales sin peligro de explosión, por ello, también son más seguras. Además, están hechas de óxidos metálicos (cerámicos) que, aunque no tienen tan buena conductividad (movimiento de iones) en su interior, se puede usar un gel para aumentar el transporte de los iones dentro de la batería, mejorando su conductividad, volviéndola más segura y menos tóxica. Además, como pueden tener “huecos” en su estructura que son de un solo tamaño y generalmente son pequeños, solo pueden pasar a través de ellas especies pequeñas, como lo son los electrones o iones, lo que les permite funcionar como una membrana-electrolito e incrementar su conductividad sin la necesidad de geles.
Con estos materiales en estado sólido se pueden construir baterías más eficientes y de materiales menos escasos, como el sodio. La principal ventaja de baterías construidas con sodio es que estarían compuestas por un elemento barato y abundante, sin embargo, se perdería su capacidad de ser portátiles, pues el sodio es un elemento más pesado que el litio. Sin embargo, estas podrían emplearse a nivel industrial.
Las principales ventajas de las baterías de estado sólido son su alta movilidad de iones en su interior y que pueden cargarse de manera rápida (hasta 5 minutos), su mayor desventaja es que debe emplearse en dispositivos que funcionen a temperaturas mayores a los 60 ºC, por lo que se espera que estos materiales sean parte de la próxima generación de baterías que están pensadas para dispositivos más grandes y que, por ende, requieren más energía para funcionar, como por ejemplo vehículos. Si bien aún quedan muchos retos y materiales por explorar, las baterías de óxidos sólidos presentan una de las soluciones más viables, simples y eficientes para solucionar los problemas de almacenamiento energético que tenemos en la actualidad.
Referencias
- Abakumov, A.M., Fedotov, S.S., Antipov, E.V. Tarascon J.M. Solid state chemistry for developing better metal-ion batteries. Nat Commun. 11, 4976 (2020).
- Callister W. D. (1995) Introducción a la ciencia e ingeniería de los materiales. Primera edición. Editorial Reverté. España. Páginas 32, 53, 72.
- Mauger A., Julien C.M., Paolella A., Armand M., Zaghib K. Building Better Batteries in the Solid State: A Review. Materials. 12(23), 3892 (2019).
- Kireeva, N.; Pervov, V.S. Materials space of solid-state electrolytes: Unraveling chemical composition–structure–ionic conductivity relationships in garnet-type metal oxides using cheminformatics virtual screening approaches. Phys. Chem. Chem. Phys. 19, 20904–20918 (2017).
- Huang, B.; Xu, B.; Li, Y.; Zhou, W.; You, Y.; Zhong, S.; Wang, C.A.; Goodenough, J.B. Ionic conductivity and air stability of Al-doped Li7La3Zr2O12 sintered in alumina and Pt crucibles. ACS Appl. Mater. Interfaces. 2016(8) 14552–14557 (2016).
- Jin, Y.; McGinn, P.J. Li7La3Zr2O12 electrolyte stability in air and fabrication of a Li/Li7La3Zr2O12/Cu0.1V2O5 solid-state battery. J. Power Sources. 239, 326–331 (2013).
Agradecimientos
Al SECIHTI por la beca otorgada: 1139636 Al financiamiento de proyectos DGAPA-UNAM: IA-107123 e IN-212025
Datos de Autor
- Departamento de Física y Química Teórica, Facultad de Química, Universidad Nacional Autónoma de México, México, CDMX, 04510, México. Contacto: [email protected] ↩︎
- Departamento de Física y Química Teórica, Facultad de Química, Universidad Nacional Autónoma de México, México, CDMX, 04510, México. Contacto: [email protected] ↩︎
Recibido: 7 de abril de 2025
Aceptado: 28 de abril de 2025
